Anvisa registra primeiro remédio à base de maconha do Brasil
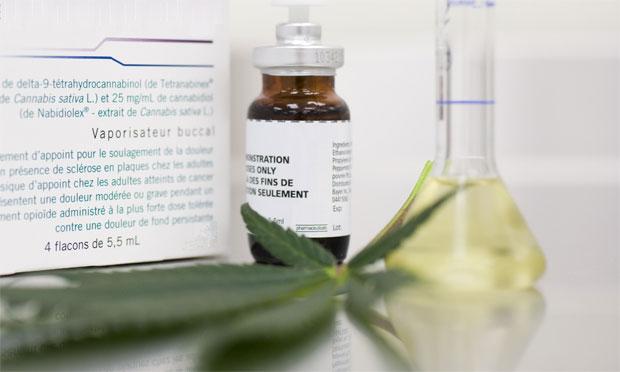 Remédio será tarja preta, só comercializado mediante solicitação médicaFoto: divulgação
Remédio será tarja preta, só comercializado mediante solicitação médicaFoto: divulgação
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do medicamento Mevatyl, destinada ao tratamento clínico de pacientes não responsivos a medicamentos antiespásticos (medicamentos que controlam a rigidez muscular). Na base do medicamento, está o canabidiol (CBD), 25 mg/mL, obtido a partir da Cannabis sativa (maconha), na forma farmacêutica solução oral (spray). É o primeiro medicamento registrado no país à base de Cannabis Sativa.
De acordo com informações da Anvisa, o novo medicamento é registrado em outros países com o nome comercial Sativex, e é indicado para o tratamento sintomático da espasticidade moderada a grave relacionada à esclerose múltipla, sendo destinado a pacientes adultos não responsivos a outros medicamentos antiespásticos e que demonstram melhoria clinicamente significativa dos sintomas relacionados à espasticidade durante um período inicial de tratamento com o Mevatyl.
O medicamento é destinado ao uso em adição à medicação antiespástica atual do paciente e está aprovado em outros 28 países, incluindo Canadá, Estados Unidos, Alemanha, Dinamarca, Suécia, Suíça e Israel.
Ainda segundo o órgão, o medicamento não é indicado para o tratamento de epilepsia, pois o THC, uma de suas substâncias ativas, possui potencial de causar agravamento de crises epiléticas. O medicamento também não é recomendado para uso em crianças e adolescentes com menos de 18 anos de idade devido à ausência de dados de segurança e eficácia para pacientes nesta faixa etária.
Mevatyl será comercializado com tarja preta em sua rotulagem e a sua venda ficará sujeita a prescrição médica por meio de notificação de receita.